Об ультраструктуре биомембран и межмембранных контактов, их биогенезе и адаптационно-компенсаторных процессах

|
Авторская работа Автор: Т. С. Аглинцян, бывшая зав. лабораторией электронной микроскопии бывшего отдела морфологии, (зав., докт. биол. наук Н. Ф. Гусакова) бывшего Ереванского филиала ВНЦХ АМН СССР, ныне Института хирургии им. А. Л. Микаеляна МЗ РА Рецензия: ? |
Аннотация
[править]Предлагаемая вниманию читателей работа имеет целью ознакомить широкую аудиторию цитологов с новым взглядом на морфологическую организацию биологических мембран (М) и межмембранных контактов, описанным нами, к сожалению, преимущественно в республиканской печати, начиная с 80-х годов прошлого столетия. По сути она является обзором собственных исследований, проведенных на материале интраоперационных биоптатов миокарда в Ереванском филиале ВНЦХ АМН СССР, созданном А.Л. Микаеляном и ныне носящем его имя – Институт хирургии МЗ РА, а также в Институте физиологии им. акад. Л.А. Орбели НАН РА. Она содержит актуальные, даже по прошествии многих лет, сведения, касающиеся указанной проблемы, полученные нами при исследовании ультраструктурных изменений миокарда больных пороками сердца. Предвидя возражения по поводу некорректности суждения о морфологической организации структур на патологическом материале, мы особо подчеркиваем исключительную роль патологии, приведшей к дезинтеграции М, что позволило разглядеть особенности строения неизвестных доселе дериватов белковой оболочки их липопротеидных субъединиц (СЕ) в трансмиссионном электронном микроскопе in situ на срезах ткани, (а не после экстрагирования этих частиц, как это принято в молекулярной биологии, которая, следует признать, внесла огромный вклад в развитие мембранологии). Именно в условиях патологии нередко проявляются такие свойства и структурные особенности клеток и субклеточных структур, которые в нормальных условиях уловить порой невозможно. И это прежде всего относится к процессам новообразования органоидов клетки, проследить которые, по мнению некоторых исследователей, значительно труднее, чем синтезировать даже самую крупную органическую молекулу [1]. Наблюдения, сделанные на патологическом материале, были подтверждены нами в норме у экспериментальных животных (и не только на нашем материале). Они заставили задуматься, как из описанных липопротеидных СЕ с обнаруженными у них особенностями строения белковой оболочки комплектуется элементарная М, и чем объяснить переход глобулярной в типичную трехслойную конструкцию на соседних участках, как осуществляются межмембранные контакты в самой клетке и между клетками, особенно нервными, чем обусловлены высокие упруго-механические свойства и избирательная проницаемость М, а также различия в строении, химическом составе и осуществляемой ими функции, как происходит рост М, их слияние и разрушение. Читатель найдет более или менее правдоподобные или чисто гипотетические ответы на поставленные вопросы в основном тексте статьи, где описано также новообразование митохондрий (Мх) мышечных клеток сердца (КМЦ) человека из ядерной мембраны, (что весьма аргументированно отрицалось у животных). Оно рассматривается, как одно из ярчайших проявлений процессов внутриклеточной регенерации КМЦ с участием М, показан механизм формирования межмитохондриальных септированных соединений (ММСС), отличающийся от известного в цитологической научной литературе, обнаружена неизвестная ранее способность этих органелл участвовать в формировании синапсов и синаптических уплотнений. Описываются также и другие ультраструктурные проявления процессов адаптации и компенсации, обнаруженные у больных пороками сердца.
Материал и методы исследования
[править]Иссеченный во время реконструктивной операции кусочек миокарда в специальном контейнере на льду на предметном стекле доставляли в отдел морфологии, отделяли фрагмент для электронной микроскопии и погружали в холодный раствор альдегидной смеси, приготовленный на фосфатном буфере по прописи Карновского [2] с заменой 50% раствора глутарового альдегида на 25%. Автор отмечает, что, несмотря на гиперосмотичность альдегидных фиксаторов, тонкая структура и химический состав ткани не нарушаются. В нашей модификации она была равна 1.63 М. Дальнейшую обработку материала проводили по общепринятой в трансмиссионной электронной микроскопии методике и заливали в смесь эпона с аралдитом. Ультратонкие срезы после двойной контрастировки уранилацетатом и цитратом свинца по Рейнольдсу просматривали в электронном микроскопе при ускоряющем напряжении 75 Кв.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
[править]Деструктивные ультраструктурные изменения КМЦ и кровеносных капилляров (КК) миокарда, тесно коррелирующие с кровоснабжением, метаболизмом и сократительной функцией, а также со степенью недостаточности сердца при приобретенных его пороках, описаны нами ранее в многочисленных работах. В настоящей статье акцентируются параллельно протекающие в них адаптационно-компенсаторно процессы, в частности, с участием мембранных структур клеток. На электронной микрофотографии (рис. 1) представлена околоядерная зона КМЦ с фрагментом ядра.


В цитоплазме клетки в центре указанной зоны видна деструктивно измененная Мх, внутри которой просматриваются мельчайшие структуры, имеющие кольцевидную головку с нежными нитевидными отростками – филаментами и более темными, утолщенными у основания ножками или “хвостиками” (дет. 1). Такие же образования – мембранные частицы (МЧ) обнаруживаются во фрагментах оболочки и полости этой Мх, но срезанные, видимо, в разных направлениях и поэтому имеющие разную форму и величину (3-10 нм) в зависимости от плоскости среза.
Фрагмент ядра отделен от цитоплазмы полосой конденсированного ядерного вещества - хроматина. Контуры ядра извилистые и образуют выступ над описанной Мх. Внутренняя ядерная М по обе стороны выступа поперечно исчерчена (отмечено стрелками). Справа через каналец в этой зоне выходит тонкая нить, возможно хроматина, а слева наружная М ядра образует выпячивания, наподобие пиноцитозных пузырьков, (обычно формируемых М клетки путем ее впячивания в цитоплазму для поглощения жидкости извне), которые окаймлены двумя-тремя, в зависимости от плоскости среза, вышеописанными МЧ. Последние соприкасаются друг с другом нежными филаментами (дет. 2).
Рядом видна цепочка уже отшнуровавшихся пузырьков, (отмеченных двусторонней стрелкой), направляющихся к вакуоли и сливающихся с нею (место слияния отмечено и на фото, и на схеме – дет.2) путем встраивания МЧ перпендикулярно плоскости М, создающих поперечную исчерченность последней. Мы полагаем, что это первая стадия (Мх 1) формирования будущих Мх.
Ниже видна сплющенная и дугообразно изогнутая вакуоль, вероятно, такого же происхождения (Мх 2), которая вобрала в себя пузырьковидно измененную кристу разрушенных Мх и вскоре превратится в двуконтурную после слияния соприкасающихся концов. Об этом можно судить по трем уже оформленным двуконтурным вакуолям разной величины (3), в которых видны единичные МЧ. Неравномерность толщины новообразованной М указана сдвоенными треугольниками в Мх 3 и 5, причем, в 5-ой видна даже структура срезанных МЧ, формирующих будущую кристу контактом головки одной с “хвостом” другой частицы (дет. 3). Выше контактирующих МЧ в этой Мх намечается образование других параллельно расположенных крист. В Мх 4 выявляется подобие кристы, у конца которой видна, отмеченная треугольником, группа МЧ. Такие же МЧ выявляются и в Мх 3.
Резюмируя описанные картины, можно допустить, что на остатках крист деструктивно измененных Мх, механизмом обволакивания попавших в двуконтурные вакуоли и служащих матрицей, путем самосборки формируются М новых крист из присутствующих кольцевидных СЕ с отростками. Известно, что специфические белки-ферменты Мх поступают из цитоплазмы и, комплексируясь с внутренними М, создают элементарные частицы – дыхательные ансамбли. Двойная оболочка вакуоли, возможно сливаясь, формирует наружную М оболочки Мх, названной нами материнской, которая будет в дальнейшем размножаться обычным способом – делением или почкованием.
У животных невозможность новообразования Мх из ядерной М считается окончательно доказанной [3].
Исследованиями И.Б. Збарского [4] показано, что из всех М клетки только ядерная имеет некоторую аналогию с митохондриальной по химическому составу и строению. Возможно, предполагаемое нами слияние обеих М оболочки двуконтурной вакуоли, образовавшейся из наружной М ядра, и создает некоторое отличие митохондриальной М от ядерной.
В том, что новообразованные органеллы действительно являются Мх, убеждает нас также факт формирования типичного для них септированного, т.е. состоящего из перегородок, межмитохондриального соединения (MMСС), отмеченного на том же рисунке звездочкой. На представленной схематически детали (дет. 4) можно видеть как клиновидные “хвостики” МЧ, (головки которых не видны под пучком электронов в силу объясняемых ниже причин), на наружной М Мх 4 направляются к мостикам-сшивкам между обеими М оболочки Мх 5, предположительно образованными противоположно направленными клиньями МЧ. Чуть выше они соединяются, создавая перегородки ММСС. Описанный механизм формирования указанных соединений отличается от известных в литературе [5]. С помощью ММСС образуются целые кластеры Мх, сообщающихся между собой и обменивающихся какими-то веществами. Допускается, что Мх 4 является донором, а Мх 5 – реципиентом.
Таким образом, наши наблюдения не исключают возможности новообразования Мх из ядерной М в условиях патологии у человека и свидетельствуют о неправомерности экстраполирования результатов экспериментальных исследований на человека в некоторых случаях.
Что же касается ДНК Мх, то считают, что она отличается от ядерной, поэтому не может иметь ядерного происхождения [6]. Попадают ли нуклеопротеиды из ядра КМЦ и ядрышка в новообразованную Мх, трудно утверждать на основании только цитологических наблюдений. Однако новейшие исследования выявили кольцевидные фрагменты ДНК ядра в комплексе с белками в цитоплазме клеток у животных. Автор предложил тест диагностики врожденного иммунодефицита у детей, созданный на основе этого исследования [7]. На нашем рисунке виден фрагмент тонкой нити, возможно хроматина, выходящий из ядра через каналец в поперечно исчерченной зоне ядерной М на выступе ядра справа, а в самой цитоплазме – кольцевидные структуры и электронноплотные зерна с нежными филаментами такой же величины и формы, как МЧ, но более темные. Не исключено, что это нити хроматина, которые, комплексируясь с белком, в цитоплазме КМЦ создают вышеописанные кольцевидные структуры ДНК, обнаруженные при иммунодефиците у человека. Кольцевидные образования с нитевидными отростками, обнаруженные нами в разреженных участках ядерного хроматина в КМЦ и ядрах эндотелиальных клеток, а также гранулярные элементарные частицы РНП по периметру ядерных пор в КМЦ больных пороками сердца примерно такой же величины, позволили выдвинуть еще одну гипотезу о сходном с МЧ строении и размерах СЕ нуклеопротеидов клетки [8], в частности так называемых нуклеосом, (по нашему допущению, имеющих сферическую форму, дающую на срезе кольцо, а не форму диска, как принято считать [9], a комплементарное соединение нитей ДНК в “хвостике” этих частиц упрощает механизм их микроделеции, обнаруженный генетиками). Это повышает вероятность их встраивания в нативную мембрану для синтеза необходимых белков М in situ, что в свое время, видимо, сыграло немаловажную роль для архаичной М, возникновения жизни на Земле и ее эволюции. Указанная гипотеза подкрепляется исследованиями, показавшими, что глобулярные структуры РНК, внешне напоминающие белковые структуры и приближающиеся к ним по свойствам, могут взаимодействовать с самыми разными молекулами, как маленькими, так и полимерными. Они могут соединяться также и с модельной мембраной [10]. А при изучении пространственного взаимоотношения РНК и белка в малой рибосомной частице (30 S) установлено, что “компактная третичная структура РНК является каркасом V- образной формы для размещения рибосомных белков преимущественно на периферии” [11], т.е. так же, как в МЧ. Приведенные данные подкрепляют наше предположение, которое, возможно, будет доказано новыми исследованиями.
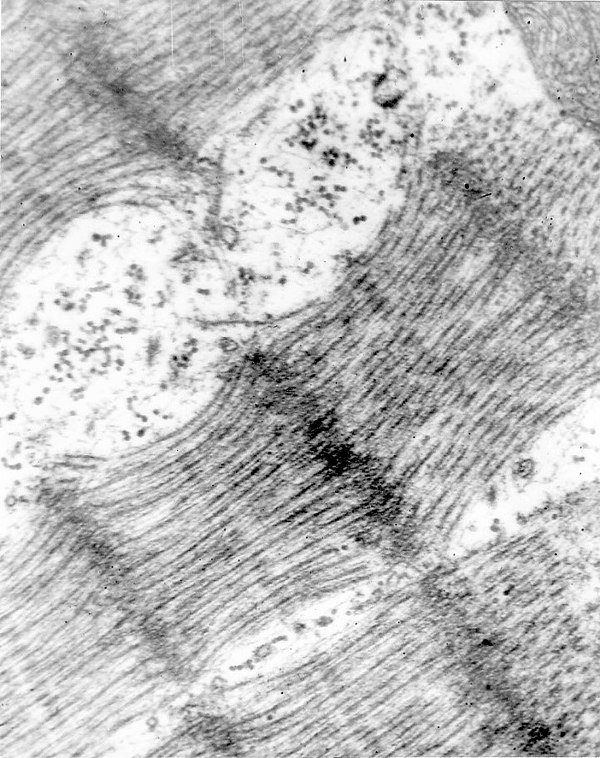
При диспергировании ряда клеточных М молекулярные биологи выделяют липопротеидные СЕ, размеры которых, по данным электронной микроскопии и показателям седиментации, соответствуют размерам глобул-шариков, обнаруживаемых в М при исследовании клеток в электронном микроскопе обычными методами и методом замораживания-скалывания. Размер глобулярных частиц варьирует в пределах 5-9 нм, из которых на электроннооптически плотную белковую оболочку липидной глобулы приходится 1-2 нм [12]. Именно белковая оболочка, по нашему мнению, формирует экваториальные филаменты и “хвост” описанных нами МЧ. Размеры МЧ настолько малы, что невозможно провести трехмерную реконструкцию по серийным срезам, так как в один, даже самый тонкий, срез могут попасть несколько рядов МЧ. Поэтому для воссоздания общего вида этих частиц мы ориентировались по форме срезанных в разных плоскостях МЧ на перпендикулярных и тангенциальных срезах М. В результате установлено, что МЧ имеют сферическую головку с экваториальными филаментами и конусовидный “хвост” (рис.2, схема, фиг. а).

На схеме показан также вид этих частиц при лонгитудинальном – продольном срезе (фиг. б) и срезе по экватору головки (фиг. в). Последний напоминает солнце с протуберанцами поэтому МЧ названы нами аллегорически АРЕВИК, что по - армянски oзначает солнышко.
При росте и слиянии М , как было видно на рис.1, происходит встраивание МЧ в предсуществующую М перпендикулярно ее плоскости, а сборка из хаотически расположенных МЧ идет путем линейного контакта головки одной с “хвостом” другой частицы (фиг. е). На этом этапе толщина М не одинакова на протяжении. Указанный феномен можно наблюдать также во фрагментах ядерной оболочки в телофазе [13], но не отмечен авторами. В дальнейшем МЧ комплектуются предположительно по-парно с помощью согнутых под прямым углом белковых “хвостов” попеременно на обеих поверхностях М (фиг. ж, и). Их головки, вероятно, несколько сближаются, соприкасаясь филаментами и согнутыми “хвостами”. В смежных рядах пары МЧ, по нашему допущению, чередуются, и М на перпендикулярном срезе через нее кажется склеенной из шариков, ввиду просвечивания частиц смежных рядов, имеющих гексагональную упаковку, т. е. расположенных в промежутках между МЧ смежного ряда (фиг. и). Такая же структура жидко-кристаллических фаз была описана для водно-фосфолипидных систем [6]. Именно регулярной упаковке белковых компонентов, отсутствующей в жидкостно-мозаичной модели биомембран [14], придается решающее значение в процессе самосборки М Мх [15]. Выпрямленные “хвосты” МЧ, выходя за пределы М, могут оставить впечатление интегральных белков, а согнутые в плоскости М – можно уподобить легко экстрагируемым периферическим белкам, как названы они в указанной выше модели М, хотя не исключено соединение упомянутых белков со структурным белком, формирующим “хвост” МЧ. В одной паре МЧ с выпрямленными “хвостами” образуются поры, которые, по-видимому, могут открываться при складывании филамент в сторону “хвоста” ( фиг. г) и закрываться при расправлении последних. Можно допустить, что филаменты, не выворачиваясь в сторону головки, действуют как клапаны. тогда легко представить, как две соседние поры осуществляют транспорт веществ в противоположных направлениях, например, противоток ионов натрия и калия в клетке.
В норме М пропускает частицы диаметром 0.4 – 0.6 нм [16]. Это, по-видимому, обусловлено щелями между филаментами МЧ, а также маленькими треугольными отверстиями, создаваемыми МЧ смежных рядов (фиг. к, отмечено стрелкой). Открытая пора может пропускать частицы диаметром 7-9 нм. Мы не исключаем различные варианты связи МЧ с помощью гибких “хвостов” в плоскости М. Перпендикулярное расположение последних к плоскости М объясняется нами переориентацией “хвостов”, а не самих МЧ в толще М (как мы думали раньше, исходя из ее жидко-кристаллической природы). Оказалось, что мембранные белки не могут совершать флип-флоп переходы с одной плоскости М на другую, но обладают способностью к вращательной и латеральной диффузии [12, 15, 17]. Особенно импонирует нам описанная способность белковых молекул совершать маятникообразные движения на поверхности М, тогда как другая часть молекулы остается прочно закрепленной в толще самой М [15]. Именно подобными движениями белковых “хвостов” МЧ, возможно создается все многообразие их связей, укрепляющих твердый каркас остова М. Биологическая подвижность М и их СЕ с дериватами белковой оболочки, возможно связанная со способностью белковых молекул к конформационным изменениям, электрическими, магнитными и др. процессами в М, может быть обусловленной также и окислительно-восстановительными ферментами, выявленными нами электронногистохимическими методами [18], причем показано, что ферментативной активностью обладают сами структурные белки М как Мх, так и сарколеммы.
Предложенная нами гипотетическая глобулярно-твердо-каркасная модель [19] остова М объясняет многие ее свойства, в том числе высокие упруго-механические показатели, т.к. МЧ относительно жестко соединены своими белковыми компонентами, придающими в то же время гидрофильные свойства М. Однако с этих позиций трудно было объяснить гидрофобные ее качества и транспорт жирօрастворимых веществ через М, а также чередование глобулярных и ламеллярных (слоистых) участков по ходу М.
Основываясь на способности амфипатических белков самопроизвольно образовывать липопротеидные мицеллы при добавлении липидов in vitro [9], мы допустили вероятность обратного процесса при изменении функционального состояния нативной М под влиянием пока неизвестных факторов, т.е. сползание белковой оболочки вместе с филаментами с головки МЧ в сторону ее “хвоста” и назвали этот процесс клиновидной трансформацией МЧ, в результате которой “хвост” частицы принимает форму клина на срезе (рис. 2, схема, фиг. з) и более интенсивно окрашивается, а липидная головка больше не контурирует под пучком электронов и становится прозрачной для него, что наблюдалось при формировании ММСС (рис. 1, деталь 4). Выпрямленные “хвосты” таких трансформированных МЧ создают частокол из клиньев на М. Электроннопрозрачные головки образуют светлый средний слой М, покрытый с обеих сторон дискретными темными белковыми слоями, образованными согнутыми в плоскости М “хвостами” МЧ, придающими слоям вид пунктира (рис. 2, схема, фиг. и). Такую конструкцию М можно увидеть на электронной микрофотографии эндотелиальной клетки из монографии Леви А., Сикевиц Ф. [1]. Не исключается также возможность пространственной перегруппировки липидных молекул с превращением их в истинный бислой под влиянием различных, пока неизвестных факторов. М в этих случаях более доступна для жирорастворимых веществ, более гидрофобна и уязвима для эндо - и экзогенных фосфолипаз, в отличие от глобулярной организации М, обуславливающей бо´льшую ее гидрофильность. и проницаемость для водорастворимых веществ. Указанный процесс, скорее всего, обратимый. Следовательно, глобулярно-твердо-каркасная конструкция М может трансформироваться в ламеллярно-твердо-каркасную. ОСТОВ М способен соединяться с разными белками-ферментами и небелковыми соединениями, представленными в гибридной модели плазматической М [16] с выраженными примембранными слоями и создавать все многообразие М.
Следует отметить, что дезинтеграция М на МЧ возможна как в физиологических условиях (ядерная М при митозе), так и при патологии, в далеко зашедших стадиях которой, по-видимому, необратимо разрушаются “хвосты” и филаменты МЧ и наступает везикуляция М с образованием мельчайших пузырьков [8, 20].
Tаким образом, с помощью предложенной модели легче объяснить разнообразие видов и свойств М, избирательную их проницаемость, механизмы формирования межмембранных контактов, роста и слияния М, биогенеза М de novo из МЧ, ее дезинтеграцию в норме и патологии, структурную изменчивость на электронных микрофотографиях, а, в случае подтверждения выдвинутой гипотезы, указанная модель М может претендовать на универсальность.
Новые сведения, полученные при анализе механизма формирования ММСС, дали толчок изучению других типов межмембранных контактов, и в частности синапсов. Анализ электронных микрофотографий показал, что в химических синапсах 1 типа (классификация Шеперда Г. [21]) “хвостики” МЧ контактируют только с постсинаптической М, МЧ которой, возможно, участвуют в формировании субсинаптического уплотнения. Необходимо подчеркнуть, что МЧ обычной М имеют липопротеиновую природу, тогда как синаптические М и субсинаптическая сеть состоят из протеолипидов с бо´льшим содержанием белка [21], и поэтому они окрашиваются интенсивнее, маскируя субъединичную организацию синаптических М. Перпендикулярная ориентация “хвостов” МЧ синаптической М увеличивает ее толщину и проницаемость. Когда медиатор высвобождается из синаптических пузырьков, филаменты МЧ постсинаптической М в активной зоне синапса, предположительно складываясь в направлении “ хвостов”, пропускают его в одном направлении, выполняя роль клапанов. Фоновая синаптическая активность может быть обусловлена существованием мельчайших щелей между филаментами МЧ синаптических М, пропускающих минимальные порции медиаторов или других биоактивных веществ.
Гексагональная упаковка выпрямленных “хвостов” МЧ обеих синаптических М в синаптической щели электрического синапса обуславливает, вероятно, наличие сотовидных структур на тангенциальном срезе через эту щель, описанных А. Питерсом и соавт.[22] и созданных, по нашему предположению, щестью парами МЧ смежных М [23].
Tаким образом, МЧ синаптических М химических синапсов формируют каналы транспортировки медиаторов, в то же время обеспечивая сцепление указанных М своими “хвостами”, что подтверждается дифференциальным центрифугированием М активных зон синапсов, всегда обнаруживаемых сцепленными. В электрических синапсах тесный контакт обеих синаптических М с формированием перегородок в синаптической щели супротивно направленными “хвостами” МЧ создает условия для проскакивания электрического сигнала.
В химических синапсах второго типа МЧ синаптических М не определяются. Это, скорее всего, связано с клиновидной трансформацией МЧ и реципрокным взаимопроникновением их “хвостов” с последующим формированием симметричной субсинаптической сети.
На электронных микрофотографиях выявлялись также поперечно исчерченные участки прилежащих друг к другу дендритов, которые очевидно образованы “хвостами” клиновидно трансформированных МЧ, создающими каналы или “микротоннели”, описанные между эритроцитом и эндотелиоцитом [24] и служащие для химической связи между ними. Известно существование невезикулярных медиаторов (дофамина) в дендритах и так называемый дендритный релизинг феномен, который наблюдается в дендро-дендритных электротонических синапсах [25]. Воздействуя на постсинаптическую М, медиатор снижает ее электрическое сопротивление, что способствует передаче электрического импульса с одного дендрита на другой [25].
В нейропиле красного ядра кошки (рис. 3) нами обнаружены оба описанных вида межнейронных связей [23].

Заслуживает внимания тот факт, что в непосредственной близости от поперечно исчерченных участков смежных М выстраиваются в ряд или группируются очень мелкие неизвестной природы электронноплотные гранулы. присутствующие в нейроплазме, Мх нервных окончаний и синаптических пузырьках. Создается впечатление, что они синтезируются в Мх и транспортируются к активным зонам синапсов для достраивания элементов синаптического комплекса. Можно допустить, что это - белок или его соединение с кальцием, необходимое для специфической функции синапсов. Строительный материал для окончательного формирования синапсов и десмосомовидных контактов может поставляться находящимися поблизости дезинтегрированными Мх [23].
На основании этих исследований был предложен следующий поэтапный механизм формирования синапсов: а) Сцепление смежных М нервных окончаний выпрямленными “хвостами” МЧ; б) Встраивание синтезированных в Мх гранул в М будущей активной зоны, что делает их более контрастными; в) Образование синаптических уплотнений с участием дезинтегрированных Мх.
В совместных работах с Авакян Л.А. [26-28] установлено не только ранее обнаруженное ею очень близкое расположение Мх к области постсинаптической М аксосоматических синапсов в спинном мозге при паратиреопривной тетании у кошек, но и формирование типичных контактов этих органелл с синаптическими М и парамембранными уплотнениями, в частности, аксодендритных синапсов (рис. 4, 5 ).


Из изложенного следует, что Мх осуществляют не только энергетическое обеспечение процесса формирования новых синапсов, но и поставляют через сохранную или частично разрушенную оболочку некоторые компоненты, необходимые для увеличения числа активных зон синапсов, повышения их осмиофилии и утолщения синаптических М, выполняя одновременно и пластическую функцию, впервые обнаруженную нами в головном мозге здоровых кошек [23].
К числу адаптационно-компенсаторных процессов в организме больного пороком сердца можно отнести также явления ауто- и гетерофагии в эндотелии КК, осуществляемые дериватами плазматической М эндотелиоцитов (рис. 6, 7).


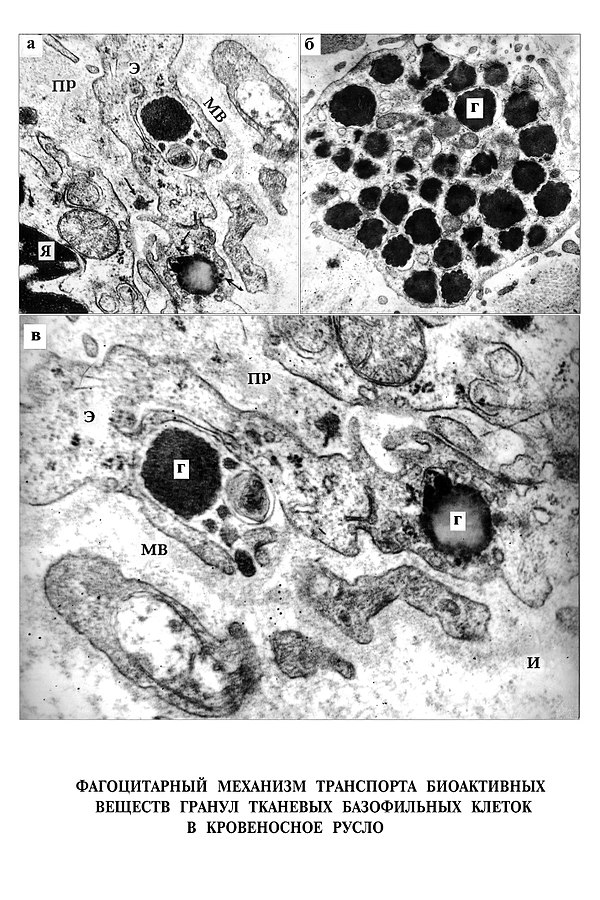

Механизм фагоцитоза идентичен механизму поглощения маркеров из просвета или межуточного пространства у экспериментальных животных. Оказалось, что фагоцитарный механизм используется также организмом кролика для транспорта гормонов надпочечника в кровь (Apkarian, R. P. 1997). Это позволяет допустить, что фагоцитарная способность эндотелия КК является универсальной и реализуется однотипно, независимо от уровня филогенетического развития, видовой и органной специфичности [29]. Последовательные эндо-экзоцитарные механизмы с участием М КМЦ и КК, выполняя адаптационно-компенсаторную роль в условиях патологии, в то же время участвуют в гормональной и гуморальной регуляции организма человека и животных в норме.
Демонстрируемый нами механизм формирования аутофагических вакуолей с помощью микропиноцитозных пузырьков (рис. 8) отличается от известных вариантов Эриксона и Миллера – Палада с участием вакуолей, описанных в литературе [29].


Ультраструктурно-морфометрический анализ КК и транскапиллярного обмена у тех же больных с недостаточностью миокарда, умеренной и выраженной недостаточностью сердца по классификации А.Л.Микаеляна [30], (соответственно I, П и Ш клинических групп), выявил тонкие механизмы компенсации, отличающиеся у больных разных клинических групп. Так, если компенсация функциональных нарушений, относительно слабо выраженная в I клинической группе, происходит за счет высокой обменной поверхности КК в условиях хорошей их перфузируемости кровью (большая площадь просвета и отсутствие реологических нарушений), то во П группе происходит выраженная активация микровезикулярного транспорта через эндотелий на фоне уменьшения обменной поверхности КК. Однако при этом нарушается нормальное, по литературным данным [24], соотношение базальных и люминальных микровезикул 2 : 1, вывленное в I группе, в результате чего нарушается выведение метаболических шлаков и наступает отек интерстиция. В Ш группе, хотя процессы микровезикуляции на М предельно напряжены, но они не в состоянии обеспечить необходимый уровень транскапиллярного обмена, т. к. условия перфузируемости КК значительно ухудшаются из-за уменьшения их обменной поверхности и резкого утолщения эндотелиального пласта. Микропузыреобразование, фигурирующее в первых двух группах, сводится к минимуму в Ш группе. Следует отметить, что транспорт веществ с помощью микропузырей у человека в норме отсутствует, он более характерен для рыб и амфибий, то есть, даже использование организмом больного филогенетически более древних путей транспорта в конечных стадиях патологии, не спасает его.
Следовательно, механизмы компенсации нарушенных функций, по-разному проявляющиеся в предыдущих группах, истощаются или оказываются несостоятельными при выраженной недостаточности сердца, то есть налицо капилляро-трофическая недостаточность сердца [31].
В проблеме структурного обеспечения длительных перегрузок миокарда и компенсации его нарушенных функций актуален вопрос о возможности увеличения числа КМЦ, которое, по мнению некоторых исследователей, происходит за счет расщепления мышечных волокон или новообразования мышечных клеток. Вместе с тем о делении КМЦ можно говорить тогда,когда факт цитотомии констатирован на уровне электронной микроскопии [32]. Исследования в этом направлении единичны и выполнены в эксперименте [33]. В нашей лаборатории впервые показано продольное и поперечное деление КМЦ у человека и продемонстрированы субклеточные механизмы реализации этого процесса с участием клеточных М [34].
Вероятно с обнаруженным феноменом связано уменьшение процента гипертрофированных клеток в Ш ультраструктурной группе КМЦ (29.5%), по сравнению со П группой, где выявлен максимальный процент этих клеток (64.4%). Показатель Ш группы почти приблизился к показателю I группы (26.8%). Это можно объяснить не только гибелью необратимо измененных КМЦ у больных Ш группы [35], но, вероятно, также и делением жизнеспособных гипертрофированных клеток для оптимизации условий их снабжения питательными веществами и кислородом и поддержания их функции. Нами отмечался также микроклазматоз – секвестрирование отдельных фрагментов предельно гипертрофированных КМЦ, что внесло свою лепту в уменьшение степени их гипертрофии, выполняя ту же компенсаторную роль у больных с выраженным повреждением КМЦ.
Одним из ультраструктурных компенсаторных проявлений можно считать обнаружение в просвете КК ушка левого предсердия длинных, анастомозирующих между собой, микроворсин эндотелиальных клеток, уменьшающих площадь просвета и, даже, перекрывающих его, по-видимому, для замедления кровотока в миокарде и более эффективного газообмена, осуществляемого эритроцитами с изначально сниженной у этих больных кислородной емкостью.
Изучение тонкой морфологии легкого и сердца у больных сочетанным пороком сердца с преобладанием стеноза левого атрио-вентрикулярного отверстия при различных степенях легочной гипертензии (ЛГ) обнаружило некоторые особенности ультраструктуры легкого и сужение просвета большинства межальвеолярных капилляров при I степени этой гипертензии [36], что подтверждает кардиальную теорию ее происхождения, рассматривающую спазм легочных КК, как индивидуальную реакцию организма, возникающую при несовершенстве кардиальных механизмов регуляции скорости кровотока и равенства дебитов правых и левых отделов сердца [37]. Процессы внутиклеточной регенерации проявляются в виде гиперплазии органелл КМЦ при ЛГ I степени и их гипертрофией при П степени, демонстрированной на рис. 9
На поздних стадиях заболевания прогрессирование ЛГ приводит к достоверному увеличению степени повреждения органелл и КМЦ в целом. На основании полученных данных ЛГ на ранних стадиях заболевания можно считать фактором компенсаторного характера, что согласуется также с мнением Шердукаловой Л.Ф [36].
Таким образом, адаптационно-компенсаторные механизмы, задействованные на ультраструктурном уровне в системах дыхания и кровообращения при митральном пороке сердца, наиболее эффективны на ранних стадиях заболевания при умеренной ЛГ.
Пусковым механизмом развития адаптивно-приспособительных процессов при этом является нарушение гемомикроциркуляции, ведущее в результате к дегенеративно-дистрофическим изменениям многих клеточных структур и стромы миокарда при пороках сердца.
Эти данные убеждают в следующем: важнейшая задача реконструктивных операций на сердце и магистральных сосудах – добиться улучшения кровоснабжения миокарда уже на операционном столе, тем самым создав в послеоперационном периоде предпосылки восстановления клеточных механизмов саморегуляции, (в которых биомембрана играет не последнюю роль), и для обратного развития патологических изменений с последующим улучшением сократительной функции миокарда.
ЗАКЛЮЧЕНИЕ
[править]В этом разделе мы решили высказать наши соображения относительно немаловажного вопроса, которым задавались мы и который, конечно, возникнет у каждого ученого-цитолога после ознакомления с работой, а именно: биологические мембраны изучаются с тех пор, как изобретен просвечивающий электронный микроскоп, и как это случилось, что только относительно недавно удалось обнаружить тончайшие производные белковой оболочки липопротеидных внутри мембранных частиц. Нам кажется, что произошло благоприятное стечение некоторых обстоятельств, об одном из которых упомянуто в Аннотации. Это - патология миокарда, приведшая к дезинтеграции М и сыгравшая роль детей, разбирающих подаренную им машинку, чтобы узнать, как она устроена.
Другим обстоятельством явилась необходимость доставки биопсированного миокарда из операционной в морфологический корпус филиала, (который находится на расстоянии от клинического корпуса) в нативном состоянии для гистохимического изучения энергообмена на криостатных срезах и параллельного его электронно-микроскопического исследования. Для этого понадобился специальный контейнер с обычным или сухим льдом. Возможно, именно кратковременное воздействие на миокард низкой температуры стабилизировало нежнейшие нитевидные отростки головок и «хвосты» дезинтегрированных МЧ, (образованные их белковой оболочкой), перед префиксацией в холодной (4 градуса по Цельсию) альдегидной смеси. Здесь хочется напомнить тот факт, что только с помощью низкотемпературной белковой кристаллографии относительно недавно удалось окончательно расшифровать структуру рибосом клетки, за что Аде Йонат в 2009 г. присуждена Нобелевская премия по химии. Между тем, эти органеллы клетки изучаются так же давно, как и биологические мембраны.
Более того, нам кажется, что указанный фактор сыграл нам на руку, позволив проследить последовательные стадии биогенеза Мх в КМЦ человека из наружного листка ядерной М, что весьма аргументированно отрицалось у животных. Удалось также продемонстрировать стадии фагоцитоза непереваренных лизосомами так называемых остаточных телец с помощью микроворсин эндотелиоцитов КК, препятствующего засорению интерстиция клеточным детритом и облегчающего дренажную функцию лимфатических капилляров, вероятно, уже не справляющихся со своей главной функцией у больных пороками сердца.
Был показан также ранее неизвестный фагоцитарный механизм поступления в кровь биологически активных веществ гранул тканевых базофилов из межклеточного пространства через эндотелий КК.
По-видимому, перечисленные выше процессы в физиологических условиях скоротечны, а низкая температура замедлила их в иссеченном кусочке ткани, позволив зафиксировать в исходном состоянии перед окончательной фиксацией альдегидами и сделать эти находки достоянием ученых с помощью обычной трансмиссионной электронной микроскопии.
И, наконец, счастливая случайность – сфотографировать именно эту околоядерную зону КМЦ с непонятными для нас тогда картинками при рабочем увеличении 43 000 с тем, чтобы потом разобраться. Это время наступило через 20 лет. Нам пришлось с лупой изучать уникальную по своей информативности электронную микрофотографию, открывшую интереснейший нано-мир в миокарде человека. Удовлетворительное для печати на бумаге качество этой микрофотографии удалось обеспечить только относительно недавно с помощью новых технологий. Вот почему у нас нет большого увеличения указанного кадра, которое сделало бы более убедительными для читателя описываемые нами процессы. Но компьютерная графика также пришла нам на помощь.
Следует отметить, что наблюдения, сделанные нами на патологическом материале были подтверждены при рассмотрении электронных микрофотографий других пациентов, а также у экспериментальных животных и не только на нашем материале. Кстати, у животных обычно проводится перфузия организма альдегидными фиксаторами перед взятием материала, т.е. исследуемые структуры префиксируются in situ, затем дофиксируются погружением.
Таким образом, нашими исследованиями показано, что трансмиссионная электронная микроскопия еще не изжила себя, а описанные новые сведения имеют важное общебиологическое значение, несмотря на то, что получены на патологическом материале. Некоторые наши гипотезы могут показаться слишком надуманными, однако можно надеяться, что будущее покажет, насколько близки были они к истине.
Список использованных источников и литературы
[править]1. Леви, А. Сикевиц, Ф. Структура и функции клетки [Текст] / А. Леви, Ф. Сикевиц., – М. “Мир”- 1971-583с.
2. Уикли, Б. Электронная микроскопия для начинающих [Текст] / Б. Уикли., – М. “Мир”- 1975 – 326 с.
3. Ченцов, Ю. С. Общая цитология [Текст] / Ю. С. Ченцов., - М. “Изд. Московского университета”- 1984 - 352 с.
4. Збарский, И. Б. Связь ядерной мембраны со структурами цитоплазмы и механизмы ядерно-цитоплазматических отношений [Текст] / И. Б. Збарский // Усп.совр. биол. -1972 -73 - вып. 1 – С 3-25.
5. Бакеева, Л. Е., Ченцов, Ю. С. [Текст] / Л. Е. Бакеева, Ю. С. Ченцов // Итоги науки и техники. Общие проблемы биологии -1989 – т.9, 103 с.
6. Новинский, В., Робертис, Э. де, Саэс, Ф. Биология клетки [Текст] / В. Новинский, Э. де Робертис, Ф. Саэс - М. “Мир”- 1973 - 487 с.
7. Продеус, А. П., Филипенко, М. Л. и др.- Премия “ Призвание” – 22 июня 2015 г. [электронный ресурс] / А. П. Продеус, М. Л. Филипенко и др. – Режим доступа: www.sbras.info/articles/science/ v-borbe-s-immunodefitsitom/
8. Аглинцян, Т. С. Надмолекулярная организация некоторых биополимеров миокарда человека [Текст] / Т. С. Аглинцян., // Доклады НАН Армении- Ереван- 2000 – т. 100 - N4 – с 342 – 349.
9. Албертс, Б., Брей, Д., Льюис, Дж. и др. Молекулярная биология клетки [Текст] / Б. Албертс, Д. Брей, Дж. Льюис и др.- М.”Мир”,1994, т.2, 539 с.
10. Власов, В. В., Власов, А. В. Жизнь началась с РНК [электронный ресурс] / В. В. Власов, А. В. Власов. – Режим доступа: www.evolbiol.ru/ vlasov.htm //“Наука из первых рук” - N2(3), 2004, С 6-19.
11. Сердюк, И. Н. Физические принципы структурной организации рибосом [Текст] / И. Н. Сердюк. – Автореф. дисс. на соискание докт. физ. мат. наук – М., 1981 – 51 с.
12. Комиссарчик, Я. Ю. Структура и функции биологических мембран [Текст] / Я. Ю. Комиссарчик - М. “Наука”, 1975, С 8-25.
13. Поляков В. Ю.,Ченцов Ю. С. Ультраструктура клеточного ядра [Текст] / В. Ю. Поляков, Ю. С. Ченцов –М. “Наука”, 1974, 174 с.
14. Singer, S. J., Nikolson G. L. The fluid mosaic model of the structure of cell membranes [Tekst] / S. J. Singer, G. L. Nikolson // Sciens - 1972, v 175, p.720 – 731.
15. Озернюк, Н. Д. Рост и воспроизведение митохондрий [Tекст] / Н. Д. Озернюк – М. “Наука”, 1978, 264с., С. 32-35.
16. Авцын, А. П., Шахламов, В. А. ультраструктурные основы патологии клетки [Текст] / А. П. Авцын, В. А. Шахламов - М. “Медицина”- 1979, 320 с.
17. Быков, В. Л. Функциональная морфология клетки (Пособие для студентов I и II курсов) [Текст] / В. Л. Быков – Санкт-Петербург- 1995- 55 с.
18. Gousakova, N. Ph., Aglintsyаn, T. S., Kukurtchian, N.S. Light and electron mikroscopic histochemical investigation of myocardium [Tekst] / N. Ph. Gousakova, T.S. Aglintsyan, N. S. Kukurtchian // World of microstructure - 1998 - N2 - p. 23.
19. Aglintsyan, T. S. The globular-solid-framework model of biological membrane [Tekst] / T. S. Aglintsyan // Proceedings 10-th annual meeting of AEMS, “Electron microscopy -2001” - Yerevan 2001 - p. 11-12.
20. Кукуртчян, Н. С., Аглинцян, Т. С. Мембранные структуры миокарда при патологии сердца в эксперименте и клинике [Tекст] / Н. С. Кукуртчян, Т. С. Аглинцян // Кровообращение - Ереван – 1999 – т. 23 –N 3 – С 3-7.
21. Шеперд, Г. Нейробиология [Teкст] / Г. Шеперд - М. “Мир”, 1987, 454 с.
22. Питерс, А., Палей, С., Уэбстер, Г. Ультраструктура нервной системы [Teкст] / А. Питерс, С. Палей, Г. Уэбстер - М. “Мир” - 1972 -175 с.
23. Аглинцян, Т. С. Ультраструктурная основа межнейронных взаимодействий в головном мозге кошки [Teкст] / Т. С. Аглинцян // Шестой съезд Армянского физиологического общества им. Л. А. Орбели, (Дoклады)- Ереван – 2001 – С. 49-51.
24. Шахламов, В. А. Капилляры [Текст] / В. А. Шахламов – М. “Медицина”, 1971 - 200 с.
25. Llinas, R, Guenfild, S. A. and Johnson, H. Electrophyziology of pars compacta cells in the vitro substantia nigra a possible mechanism for dendritic release [Tekst] / R. Llinas, S. A. Guenfild and H. Johnson // Brain Research – 1984 – v.294 N3 – p.127 – 132.
26. Aглинцян, Т. С., Авакян, Л. А. Митохондрии нервных окончаний спинного мозга кошек при паратиреопривной тетании [Текст] / Т. С. Аглинцян, Л. А. Авакян // Доклады науч. конф. Института физиологии им. акад. Л. А. Орбели НАН Армении, посвященной 60-летию основания института , 6-7 октября 2003 – Ереван - 2004 – “Гитутюн” - С. 27-30.
27. Aглинцян, Т. С., Авакян, Л. А. О возможности кальций-регулирующей и синапсогенной функции митохондрий нервных окончаний при паратиреопривной тетании у кошек [Teкст] / Т. С. Аглинцян, Л. А Авакян // Доклады НАН Армении – 2004 - т. 104 – N2 – С. 143 – 148.
28. Аглинцян, Т. С., Авакян, Л. А. Об участии митохондрий в формировании синапсов в норме и при паратиреопривной тетании [Текст] / Т. С. Аглинцян, Л. А. Авакян // VII Всероссийская конф. по патологии клетки. Сборник науч. трудов – М. – 2005 – С. 6-7.
29. Аглинцян, Т, С. Некоторые особенности ультраструктурной организации эндотелия кровеносных капилляров миокарда человека [Teкст] / Т. С. Аглинцян // Биологический журнал Армении – Ереван - 1995 – 3-4 (48) – С. 36-41.
30. Микаелян, А. Л. Стадии развития сердечной недостаточности [Текст] / А. Л. Микаелян // Сборник науч. трудов : Недостаточность миокарда - Ереван – 1969 – С. 3 – 8.
31. Отчет о научно-исследовательской работе “Ультраструктурные изменения микроциркуляторного русла миокарда при приобретенных пороках сердца” (заключительный). Науч. рук. работы Т. С. Аглинцян// ВИНИТИ Инв. N 02850034366 – Eреван – 1985 – 43 с.
32. Саркисов, Д. С. Структурные основы адаптации и компенсации нарушенных функций [Текст] / Д. С. Саркисов – М. “Медицина” – 1987 – 448 с.
33. Шперлинг, И. Д., Артемян, И.А., Никогосова, М. И. [Текст] / И.Д. Шперлинг, И. А. Артемян, М. И. Никогосова // IV конф. по Ультраструктурным основам патологии органов и тканей.- Тбилиси – 1989 – с. 299.
34. Кукуртчян, Н. С., Аглинцян, Т.С. О механизмах деления мышечных клеток миокарда при гипертрофии сердца человека [Текст] / Н. С. Кукуртчян, Т. С. Аглинцян // Вестник хирургии Армении – Ереван – 1993 – N2 – с. 76-80.
35. Гусакова, Н. Ф., Мамян, Г. А., Аглинцян, Т.С. и др. Сравнительные параллели гистохимических, электронномикроскопических и светооптических исследований миокарда при приобретенных пороках сердца [Текст] / Н. Ф. Гусакова, Г. А. Мамян, Т. С. Аглинцян // Кровообращение – 1986 – т.19 – N3 – С. 9-13.
36. Аглинцян, Т. С., Назинян, С. Л., Айвазян, Р.А. Тонкая морфология легкого и сердца у больных сочетанным пороком сердца с преобладанием стеноза ЛАВО при различных степенях легочной гипертензии [Teкст] / Т. С. Аглинцян, С. Л. Назинян, Р.А. Айвазян // Тез. междунар. науч. конф., посвященной 20-летию основания Института хирургии им. А. Л. Микаеляна “Современные аспекты реконструктивной хирургии” - Ереван – 1994 – С.187-188.
37. Шердукалова, Л. Ф. Патогенез легочной гипертонии при ревматических пороках сердцa [Teкст] / Л. Ф. Шердукалова // Cor et vasa, Ed. ross - 1983 – 25 (4) – p. 241 - 252
БЛАГОДАРНОСТИ
[править]Хочу выразить свою искреннюю благодарность и признательность так рано ушедшему из жизни всеми любимому директору Филиала ВНЦХ АМН СССР, профессору и члену-корреспонденту НАН РА Александру Львовичу Микаеляну, а также зав. отделом морфологии Гусаковой Н.Ф,. создавшим идеальные условия для плодотворной научной работы, супруге и коллеге директора, заслуженному деятелю науки, проф. Л.Ф. Шердукаловой и академикам НАН РА Карагезяну К. Г. и Фанарджяну В.В. , а также заслуженному деятелю науки СССР член-корр. АМН СССР проф. Шахламову В.А. за высокую оценку и поддержку моих новаторских идей, всем сотрудникам лаборатории электронной микроскопии, и особенно инженеру Мовсесяну Сурену за добросовестное выполнение своих обязанностей. Я благодарна также за тот микроклимат, который царил в лаборатории и в отделе по примеру всего филиала, Адибекяну Вигену за компьютерно-графическое изображение некоторых деталей микрофотографии, представленной в данной работе.
СПРАВКА ОБ АВТОРЕ
[править]Аглинцян Такуи Суреновна, канд. мед. наук, бывшая зав. лаб. электронной микроскопии отдела морфологии (зав. докт. биол. наук ГУСАКОВА Нинель Филипповна) Ереванского филиала ВНЦХ АМН СССР, директором которого был основатель сердечно-сосудистой хирургии и трансплантологии в Армении, член-корр. НАН РА, профессор МИКАЕЛЯН Александр Львович. После смерти директора в 1991 г. Филиал стал Институтом хирургии им. А.Л. Микаеляна. В настоящее время автор представленной работы находится на пенсии. E-mail: tagush.aglintsyan@gmail.com tel.: +37410625164
| Разрешение на использование этой работы хранится в архивах системы OTRS — ссылка на разрешение. Если вам требуется подтверждение, свяжитесь с кем-либо из участников, имеющих доступ к системе. |
